Last Updated: February 18, 2025
Debido a la migración de themedicalbiochemistry.org a una plataforma de WordPress, la versión en español ya no estará disponible, por lo tanto, la redirección a la versión en inglés del sitio.
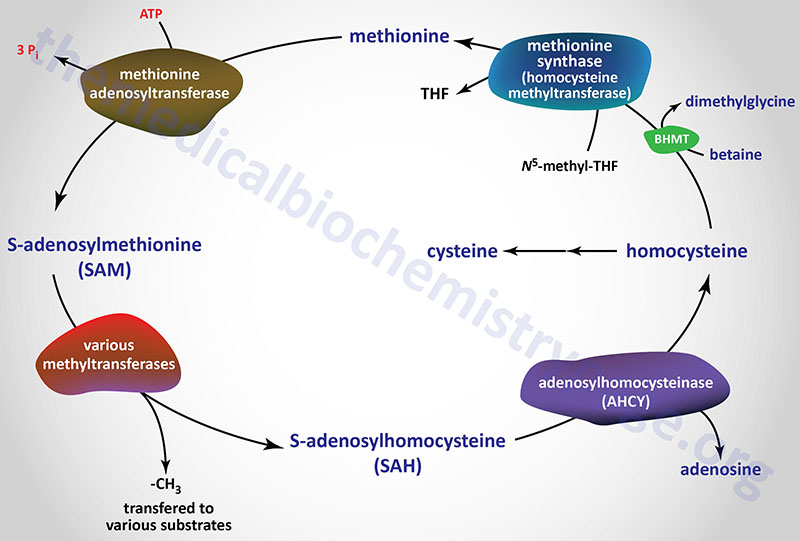
Amino Acid Biosynthesis and Catabolism